НА УРОЦІ РОЗГЛЯНУЛИ:
1. Вологість повітря.
2. Абсолютна та відносна вологість повітря.
3. Парціальний тиск.
4. Точка роси.
5. Вимірювання вологості повітря
ЗАПАМЯТАЙТЕ
Вологість повітря - одна з головних складових
здорового мікроклімату в житловому або виробничому приміщенні
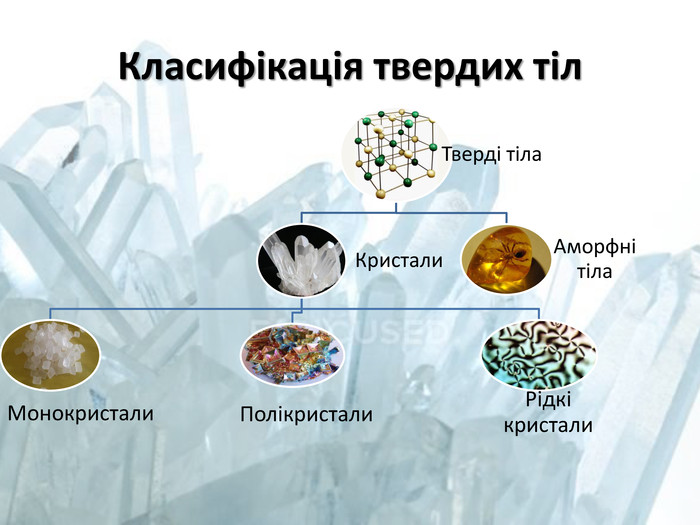
Вологість
– це міра, що характеризує вміст водяної пари у
повітрі. Розрізняють абсолютну та відносну вологість повітря.
Абсолютна
вологість – це маса водяної пари, що міститься в
1 м3 повітря за даної температури (тобто це є густина водяної пари:
). В СІ виражається в кг/м3,
але на практиці зручніше виражати в г/м3.
Ступінь вологості,
тобто характеристику наближення стану пари у повітрі до стадії насичення (при
насиченні припиняється випаровування води) показує відносна вологість.
Відносна
вологість – це відношення густини водяної пари за
деякої температури (абсолютної вологості повітря) до густини насиченої водяної
пари за тієї ж температури.
Відносну вологість зазвичай визначають у
відсотках; вона не може бути більшою, ніж 100%.
Відносна
вологість – це відношення парціального тиску водяної
пари за даної температури до тиску насиченої пари за тієї самої температури.
Парціальний
тиск
– це тиск, який чинила б водяна пара, коли б
не було інших газів.
Якщо кількість молекул
водяної пари у повітрі не змінюється, то при його нагріванні відносна вологість
зменшується, а при охолодженні зростатиме, доки не досягне значення 100%
(водяна пара стає насиченою).
Точка
роси – температура, при якій пара стає
насиченою (починається конденсація: з’являється туман, випадає роса).
ДОМАШНЄ ЗАВДАННЯ
1. Підручник (Бар.): вивчити § 32.
Вправа 32 (1-3) - усно.
2. Підготуватися др ЛР №8 "Вимірювання відносної вологості повітря"
ГОТУЄМОСЯ ДО УРОКУ